陳良課題組在《proceedings of national academy of sciences》上發表新型肺癌抑癌基因的原創性成果
2018-04
文章來自:admin 閱讀次數:2822
肺癌是全球範圍内的第一大癌。無論發病率還是緻死率,在我國都是位列所有癌症之首。因為人們對肺癌癌變機理的認識,臨床上治療肺癌的手段已從早期僅有化療可選,到了現在有靶向治療等精準治療。這主要歸功于科學家們對肺癌中癌基因的認識。遺憾的是,仍然有一部分靶點陽性的病人對相應的靶向治療不敏感。這提示癌基因以外的因素在影響着治療的效果。抑癌基因的功能缺失能極大地影響肺癌細胞對藥物的相應。抑癌基因是一個複雜的課題,目前對肺癌的抑癌基因尚未進行系統的研究。
我院陳良研究員一直緻力于肺癌的臨床轉化研究,陳良實驗室最近系統鑒定了肺癌的抑癌基因。為了回答這一問題,陳良教授實驗室首先對病人的肺癌樣品和癌旁組織樣品中的基因表達進行了組學水平的分析,确定了肺癌中低表達的基因;通過文獻調研,進一步确定了肺癌中功能尚未研究的基因;再通過臨床資料的分析,确定了對病人生存有預測作用的基因。通過這三步分析,确定了55個潛在的新型肺癌抑癌基因。
陳良研究員實驗室進一步利用肺癌的專基因小鼠模型在體驗證這些基因的功能。他們利用同一個慢病毒同時表達Cre重組酶、CRISPR引導序列和CAS9 DNA切割酶。該病毒能通過Cre激活專輯小鼠肺上皮細胞中的突變Kras,CRISPRE/CAS9則能敲除肺上皮細胞中指定的基因。這個系統能高效地考察一個基因的敲除對肺癌形成是否具有促進作用。采用該系統,陳良實驗室鑒定了5個新型的肺癌抑癌基因(Utx, Ptip, Acp5, Acacb, 和Clu)。
為了研究這些抑癌基因的發揮生物學功能的機理,他們将UTX的條件敲除小鼠和lsl-Kras G12D轉基因小鼠交配。研究發現敲除UTX基因極大地促進了肺癌的進展,進一步研究發現UTX敲除促進了腫瘤内的EZH2的表達水平,從而提高腫瘤内的H3K27me3修飾水平。有趣的是,這些腫瘤對EZH2的抑制劑治療敏感。
此項研究成果發表在《proceedings of national academy of sciences》上(In vivo CRISPR screening unveils histone demethylase UTX as an important epigenetic regulator in lung tumorigenesis,doi:10.1073/pnas.1716589115)。
陳良實驗室博士一年級的學生田娅慧是本文的共同第一作者,陳良研究員是該論文的共同通訊作者。論文的署名單位有:中國科學院上海生物化學與細胞生物學研究所,太阳集团app首页生命與健康工程研究院,紐約大學Langone醫學中心,複旦大學,美國德州大學MD Anderson癌症中心,美國國家健康研究員(NIH)糖尿病與消化、腎病研究所和上海科技大學。
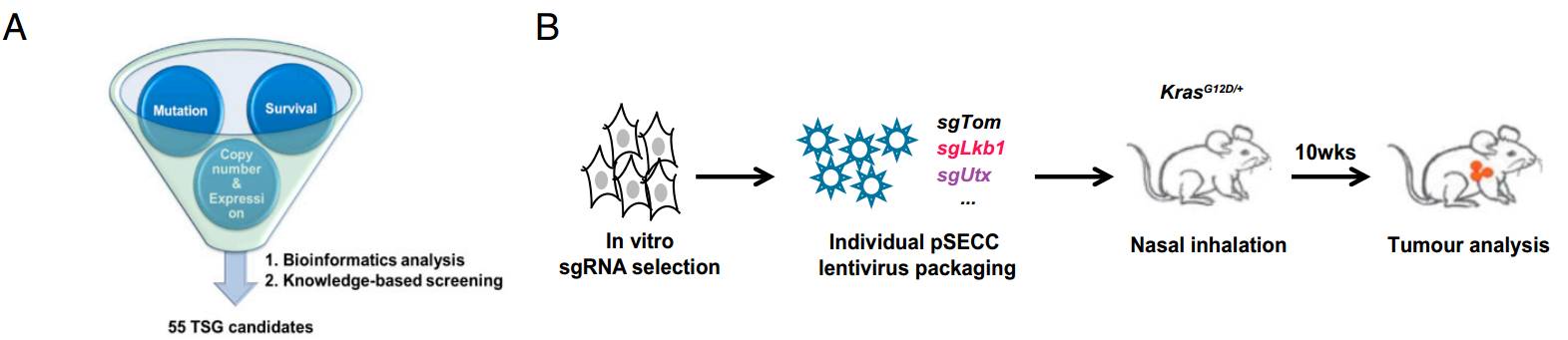
A.生物信息學結合臨床數據确定肺癌抑癌基因候選基因。
B.體内篩選抑癌基因的流程示意圖

C.體内敲除候選基因後對lsl-Kras G12D轉基因小鼠成瘤的影響
D.敲除候選基因後肺表面可見肺癌的數量
E.敲除候選基因後肺癌的直徑
F.敲除候選基因後肺癌的病理染色結果
文章鍊接:http://www.pnas.org/content/early/2018/04/04/1716589115.short?rss=1
原文摘要:
Lung cancer is the leading cause of cancer-related death worldwide. Inactivation of tumor suppressor genes (TSGs) promotes lung cancer malignant progression. Here, we take advantage of the clustered regularly interspaced short palindromic repeats (CRISPR)/Cas9-mediated somatic gene knockout in a KrasG12D/+ mouse model to identify bona fide TSGs. From individual knockout of 55 potential TSGs, we identify five genes, including Utx, Ptip, Acp5, Acacb, and Clu, whose knockout significantly promotes lung tumorigenesis. These candidate genes are frequently down-regulated in human lung cancer specimens and significantly associated with survival in patients with lung cancer. Through crossing the conditional Utx knockout allele to the KrasG12D/+ mouse model, we further find that Utx deletion dramatically promotes lung cancer progression. The tumor-promotive effect of Utx knockout in vivo is mainly mediated through an increase of the EZH2 level, which up-regulates the H3K27me3 level. Moreover, the Utx-knockout lung tumors are preferentially sensitive to EZH2 inhibitor treatment. Collectively, our study provides a systematic screening of TSGs in vivo and identifies UTX as an important epigenetic regulator in lung tumorigenesis.

