基于lncRNA實現骨質疏松的精準靶向基因治療
2021-06
文章來自:太阳集团1088vip 閱讀次數:592
基因治療是精準醫療領域的前沿方向,是21世紀醫學發展的核心領域。在該領域中非編碼RNA因不翻譯為蛋白質,在基因藥物開發方面擁有天然優勢,其中長鍊非編碼RNA(lncRNA)因數量多,調控方式多樣且功能重要,有望成為基因治療藥物開發的最大靶點庫。但lncRNA作為基因治療靶點進行臨床轉化仍面臨着基因藥物難以精準靶向遞送、基因藥物容易誘發免疫反應等瓶頸問題。因此,突破領域内的瓶頸問題是推動lncRNA精準基因治療從基礎研究走向臨床應用的關鍵環節。
2021年6月3日,太阳集团app首页王一飛團隊、北京航空航天大學王曉剛團隊、同濟大學孫瑤團隊、北京航空航天大學張永彪團隊深度合作,在Nature Communications雜志發表文章A functional motif of long noncoding RNA Nron against osteoporosis。合作團隊經過六年攻關,通過多學科交叉融合,提出針對lncRNA功能元件的精準基因治療理念,構建了基于信息學算法的lncRNA功能元件篩選體系,開發了細胞靶向的骨質疏松基因治療遞送系統,在動物模型中實現了骨質疏松的精準靶向基因治療。

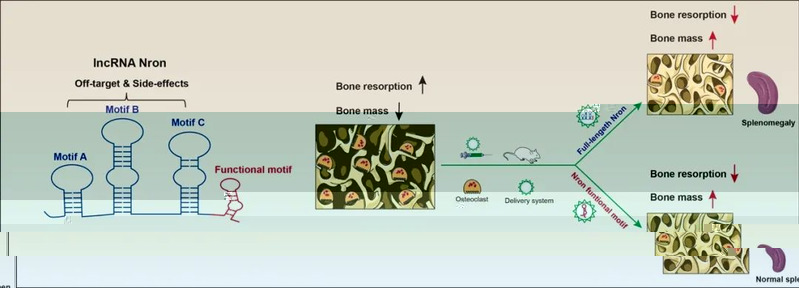
在研究的前三年,聯合攻關團隊結合高通量測序和信息學算法,鑒定到多個攜帶功能元件且具備潛在骨吸收調控活性的lncRNA分子。随後研究團隊通過構建破骨細胞特異性基因敲除小鼠和轉基因小鼠從體内深入分析了代表性lncRNA Nron的分子功能,從體内證實了lncRNA對骨吸收的關鍵調控作用,并利用體内外模型揭示了Nron通過泛素E3連接酶CUL4B調控雌激素受體ERα降解進而調控骨吸收的分子機制。随後研究團隊利用課題組構建的骨吸收靶向基因藥物遞送系統,開展了Nron體内基因治療對抗骨質疏松的效應評價,結果顯示Nron基因治療能夠抑制小鼠骨吸收并對抗骨質疏松。
但同時,研究團隊發現Nron基因治療導緻小鼠出現了脾髒腫大的現象,說明全長Nron分子用于基因治療存在明顯的副作用。為解決全長lncRNA基因治療的副作用問題,研究團隊首次提出了lncRNA功能元件精準基因治療的理念,通過“去僞存真,去粗存精”的方式,甄别并驗證了全長lncRNA中的關鍵功能決定序列,将其命名其為lncRNA functional motif。基于此理念,研究團隊結合信息學、生物學、遺傳學方法對Nron的功能元件進行了鑒定,最終發現功能元件NCM2(長度為全長Nron分子1/10)可發揮Nron全長分子的骨吸收調控活性。通過基因治療劑量、治療周期等多方面的探究,研究團隊發現功能元件NCM2體内基因治療可高效對抗小鼠骨質疏松,其效應與臨床用藥唑來膦酸鈉相當。更重要的是,功能元件NCM2體内基因治療未導緻小鼠出現脾腫大的副作用。由此說明作為全長分子精華的lncRNA功能元件是更為安全的基因治療藥物開發對象。
綜上所述,該研究所提出的lncRNA功能元件理念和精準靶向幹預策略有望促進lncRNA基因治療藥物的開發,具有重大的理論意義和重要的應用價值。
王一飛課題組長期從事創新藥物研究開發,主持完成國家“十二五”科技支撐計劃、國家“863”計劃、國家自然科學基金、國家重大新藥創制項目、廣東省國際合作項目等50餘項;獲得了國家新藥臨床批件3項;獲得中國專利優秀獎4項、中國産學研合作創新獎1項、省級科技進步獎二等獎1項、三等獎1項和廣州市科技進步獎二等獎1項;主編著作5部;獲得國際PCT專利授權2項;申請專利213項,授權專利45項;SCI、EI收錄學術論文100餘篇。在本研究中,太阳集团app首页金富軍(現為王曉剛課題組博士後)、同濟大學李俊輝、北京航空航天大學張勇彪、太阳集团app首页華僑醫院劉湘甯為論文的共同第一作者;太阳集团app首页王一飛教授、北京航空航天大學王曉剛研究員、同濟大學孫瑤教授為論文的共同通訊作者。
原文鍊接:https://www.nature.com/articles/s41467-021-23642-7

